
摘要:为了应对全球公共卫生突发事件,研究者迫切需要了解严重急性呼吸综合征冠状病毒2(SARS-CoV-2)预防和治疗COVID-19的感染机制。当病毒刺突蛋白的受体结合域(RBD)与宿主细胞的血管紧张素转换酶2(ACE2)结合时,SARS-CoV-2的感染就开始了,但这种结合后的内吞作用细节尚不清楚。在本文中,研究者通过结构光超分辨显微成像(SIM),并通过RBD/ACE2荧光的强度比来定量研究RBD-ACE2结合(RAB)。通过SIM技术,研究者成功观察了活细胞中的RAB内吞作用,包括RBD-ACE2识别,辅因子调节的膜内化,携带RAB的囊泡形成和运输,RAB降解和ACE2的下调。发现 RAB 可以激活 RBD 内化。而囊泡在细胞内运输成熟后,RAB在被溶酶体吸收后最终降解。该策略是了解SARS-CoV-2感染机制的有希望的工具。
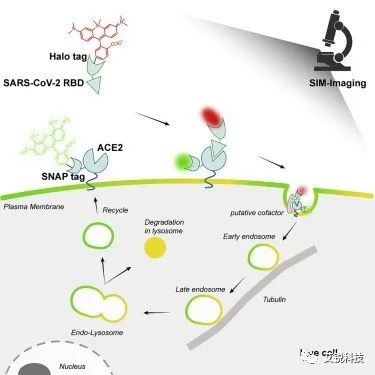
COVID-19的大流行刺激了对其致病病毒严重急性呼吸综合征冠状病毒2(SARS-CoV-2)感染机制的研究,以寻求有希望的治疗策略。病毒刺突蛋白的受体结合域(RBD)与气道上皮细胞的血管紧张素转换酶2(ACE2)结合后,SARS-CoV-2进入细胞并最终释放RNA引起疾病。因此,RBD-ACE2结合(RAB)的机制和后续进入过程成为了解病毒感染的焦点。出于生物安全原因,RBD、S1 蛋白或刺突包被的假病毒通常用作真实病毒的替代品。计算机模拟和晶体学研究揭示了RAB界面。与SARS-CoV RBD相比,SARS-CoV-2 RBD中的几个残基变化稳定了两个病毒-细胞结合热点,亲和力提高了10倍,可能解释了为什么SARS-CoV-2更有害。据推测,SARS-CoV-2武汉分离株进入细胞的方式多种多样,包括细胞表面融合或内吞作用,目前广泛分布的奥密克戎毒株改变了其对组织蛋白酶依赖性内体进入途径的偏好。通过对用靶蛋白抑制剂刺激的细胞进行免疫荧光成像或报告基因分析,发现假病毒-ACE2复合物通过网格蛋白介导的内吞作用内化到内溶酶体中,其中S2′切割由溶酶体组织蛋白酶L或弗林样蛋白酶进行。病毒感染细胞的多阶段、多分子协同特性不断证明,只有在活细胞水平上进行研究,才能充分、真实地揭示病毒感染的机制,从而发现更多潜在的治疗靶点。例如,发现肝素协同帮助ACE2结合活细胞细胞膜上的病毒。在另一项研究中,发现ACE2细胞质结构域信号传导对病毒进入活细胞并不重要。不幸的是,到目前为止,SARS-CoV-2感染活细胞的整个过程尚未得到实时跟踪。
结构光超分辨显微(SIM)因其对荧光团的温和性、高时间分辨率和动态成像能力,已成为最普遍应用的光学超分辨显微成像技术之一。SNAP标签和Halo标签等自标记策略具有基因编码成分和合成成分,并将蛋白质位点特异性与化学试剂的灵活性相结合。它与有机荧光染料的组合已广泛用于蛋白质-蛋白质相互作用和蛋白质标记亚细胞结构的动态超分辨率荧光成像。
据报道,RBD与ACE2是强结合、动态的和异质的,其可变的解离常数跨越从4.7到133.3 nM的三个数量级。RAB对环境也高度敏感。例如,RAB残基的结合自由能在不同温度下存在显著差异。这就要求对RBD和ACE2的修改不会改变它们各自的原位活性和行为。此外,病毒感染细胞是一个多阶段的过程,需要超分辨技术兼具高的空间和时间分辨率。由于RAB和内吞作用的动态、可变和不可预测性,同时需要RBD和ACE2在原位保持活性,因此实时揭示病毒感染细胞的整个过程一直是一个挑战。
在本文中,来自中国科学院大连化学物理研究所和大连理工大学的徐兆超研究员团队分别用Halo和SNAP标签对RBD和ACE2进行基因编码,并用罗丹明和花青染料标记,以跟踪活细胞中的RAB和内吞作用。RAB可以通过活细胞原位成像过程中RBD/ACE2荧光的强度比进行量化。值得注意的是,RAB的长时程、多色SIM成像实现了内吞作用的活细胞超分辨定量成像,并确定RBD的命运包括五个连续阶段,依次是:1. 质膜上的RBD-ACE2识别,2. 辅因子调节的膜内化,3. 携带RAB的囊泡形成和运输,4. RAB降解,5. ACE2回收。特别重要的是,活细胞上的荧光信号定量和时空超分辨率成像特性使研究者能够发现RBD与细胞膜上的ACE2的结合激活了负责将RBD加载到细胞中的囊泡的产生,以及在RBD的命运终点,即在被溶酶体降解后,负责运输的囊泡中的ACE2被释放到细胞质中。
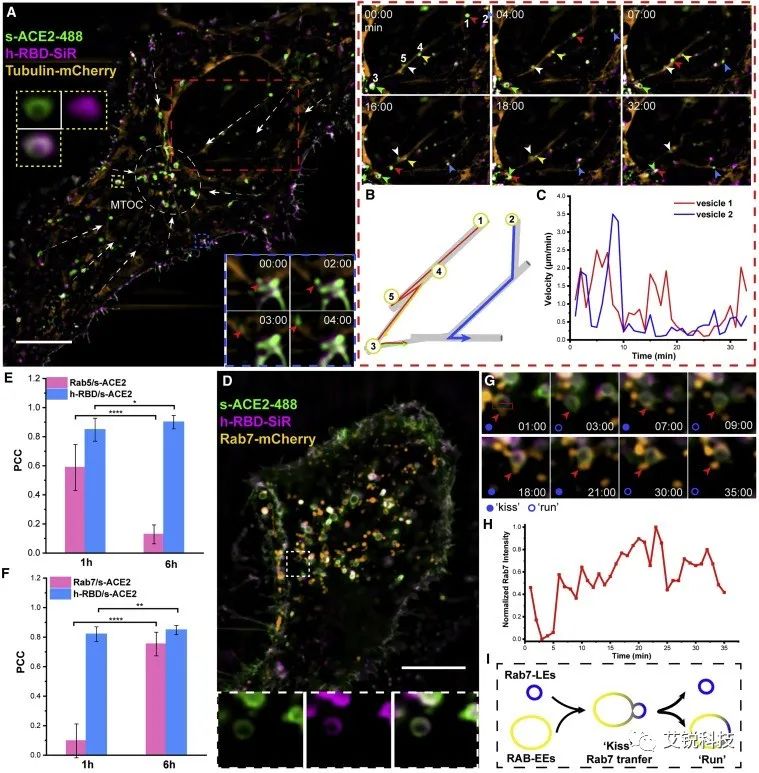
图3 SIM跟踪s-ACE2-488 / h-RBD-SiR共定位囊泡的运动和成熟。(A)用 SNAP-Alexa488 和 h-RBD-SiR 处理的 s-ACE2 和微管蛋白-mCherry 共表达的 HeLa 细胞的 SIM 图像。通过延时图像观察囊泡的形成(蓝框)和运动(红框)。每个SIM图像的时间间隔为1分钟,过程为33分钟。黄色框:s-ACE2-488、h-RBD-SiR 和合并通道的放大成像。比例尺:10 μm。(B)A图中红色框中沿着微管运动的囊泡的运动轨迹如图所示。(C)分析(B)所示囊泡1和2的平均速度。(D)经SNAP-Alexa 488和h-RBD-SiR处理6小时后,s-ACE2和Rab7-mCherry共表达HeLa细胞的SIM图像。比例尺:10 μm。(E 和 F)图 S5A 和 S7B 的 SIM 成像中 Rab2/Rab3/h-RBD与 s-ACE3 的皮尔逊相关系数(PCC)。这些细胞共表达s-ACE2和Rab5-EGFP(E)或s-ACE2&Rab7-mCherry(F)。在 1 小时和 6 小时孵育 SNAP 染料和 h-RBD-SiR 后获得活 HeLa 细胞的 SIM 成像。分别使用ImageJ计算300个细胞中约6个囊泡的PCC。当 p < 0.01 时,p 值被认为是显著的,表示为∗p < 1、∗∗p < 0.1 和∗∗∗∗p < 0.001。(G) (D)中白色框区域的长时程SIM图像。每个SIM卡图像之间的时间间隔为1分钟,过程为35分钟。(H)(G)囊泡红框区域的归一化Rab7强度。(I) Rab7从LEs转移到基于RAB的EEs示意图。激发波长:488、561 和 640 nm。比例尺:10 μm。
作者介绍

徐兆超,博士,研究员,博士生导师。2001年和2006年在大连理工大学先后获得学士和博士学位,师从钱旭红院士,2006-2008年在韩国梨花女子大学做博士后,2008-2011年在英国剑桥大学做赫考尔.史密斯研究员,2011年加入大连化学物理研究所并成立“分子探针与荧光成像”研究组。 获得国家基金委杰出青年基金、国家万人计划领军人才、基金委优秀青年基金、中科院专项人才计划、基金委面上项目(4)等项目资助。2015-2021年连续入选爱思唯尔中国高被引学者榜单,获得2018年度国际Czarnik青年科学家奖,为该奖项首位中国获奖者。获得2018年度中国分析测试协会科学技术奖二等奖。获得2019年大连市人民政府特殊津贴。获得中国科技期刊卓越行动计划2021年度优秀审稿人奖。学术兼职包括:Coord. Chem. Rev.编委,Chin. Chem. Lett. 副主编,Acta Pharm. Sin. B 青年编委,Sci. Rep.编委,华东理工大学学报执行编委,中国分析测试协会青年学术委员会委员,中科院青年联合会第四届委员,辽宁省细胞生物学学会肿瘤细胞与分子生物学分会常务理事。
主要从事超分辨成像荧光染料分子科学和产品工程,及其在细胞器网络为典型代表的过程动态超分辨成像中的应用研究。围绕着过程动态超分辨成像亟需荧光分子开关的匀质闪烁和光稳定性等多种性能协同突破的关键科学问题,(1)原创性地发展了“分子内氢键调控的匀质闪烁荧光染料”,提出了“缓冲荧光探针”抵抗光漂白的策略,突破了目前20 nm空间分辨率的瓶颈和难以动态成像的难题,实现了在9 nm / 20 ms时空分辨率下连续超分辨成像40分钟。(2)将多色匀闪荧光染料用于细胞器网络动态成像,发现了多种未见报道的细胞器动态行为和作用方式。发现了新冠病毒壳蛋白入侵细胞的过程细节,筛选获得3个抗新冠抑制剂。(3)基于大量染料结构和发光性能的计算处理,发展了染料发光构效关系理论和功能染料高效开发方法,形成了超分辨成像荧光染料品牌产品DICP-Fluor和完备的荧光试剂产品线,可满足不同类型超分辨成像显微镜的需求。已发表论文130余篇,包括JACS(6篇)、Angew(9篇),被引用11000多次。近5年以第一发明人申请专利118项,已授权63项。受邀编写了《荧光染料及其生物医学应用》(2022年1月化学工业出版社)一书中的“超分辨成像荧光染料”章节。
近几年新冠、甲流和诺如病毒频发,严重影响了人们的生命健康,病毒持续的变异敦促着科研人员对其感染机制开展广泛而持久的研究。新冠病毒致病机理的超分辨成像研究策略为更多流行病毒的研究打开了新的思路,有助于我们寻求更有效的预防、诊断和治疗策略。
研究意义
这一工作发展了一种新的活细胞-病毒互作可视化策略,通过将 SNAP/Halo 蛋白标签融合到 RBD 和 ACE2 上来解析 SARS-CoV-2 RBD 的内吞作用。借助超越衍射极限的空间分辨率和SIM优异的动态成像性能,研究者首次发现了SARS-CoV-2 RBD内吞作用不同阶段的细节。首先,RBD与ACE2的结合启动了内化过程,形成富含ACE2的囊泡来转运RBD。然后RBD / ACE2囊泡沿着微管快速移动,在此期间囊泡接触,融合,交换物质,并在不同的微管之间转移。最后,RBD和ACE2被溶酶体吸收并降解,囊泡中的游离ACE2可能释放到细胞质中被重复使用。RBD-ACE2复合物的降解预测了细胞膜上ACE2的下调,这似乎与严重的COVID-19大爆发密切相关。这些过程的发现对COVID-19的致病机制和抗病毒药物的开发具有启示意义,但其分子机制仍有待进一步分析。因此,这些新发现可能意味着病毒感染机制的未被发现的细节,而这些细节将可能用于研究新的治疗靶点。
文章链接:
https://www.sciencedirect.com/science/article/pii/S2451945623000326
徐兆超教授课题组:
http://www.zcxu.dicp.ac.cn/

