
在细胞中,多种生物大分子作为组装复合体发挥作用,而这些功能往往依赖于组分分子排布方式的动态变化,例如马达蛋白沿着细胞骨架运动时的构象变化(1-3)、F1-ATPases的旋转运动(4)、整合素的弯曲和延伸(5, 6)等。利用荧光分子的偶极子特性,荧光偏振显微镜(Fluorescence polarization microscopy, FPM),特别是超分辨荧光偏振显微镜(如polarSIM(7), FluoPolScope(8)等),已成为研究荧光分子取向、揭示分子结构和动力学的有力工具。而实现荧光偏振解析分子取向的关键,在于荧光探针与生物分子之间的刚性结合。
2021年1月,来自日本Tokyo Medical and Dental University的Sumio Terada教授团队在《美国国家科学院院刊》 (PNAS)发表题为“POLArIS, a versatile probe for molecular orientation revealed actin filaments associated with microtubule asters in early embryos”的研究论文(9)。该工作提出了一种普适性方案,利用基因编码的荧光探针进行荧光偏振成像,并通过噬菌体展示技术实现探针与特定生物分子的靶向结合。以肌动蛋白丝的偏振成像为实例,该工作合成了一种与肌动蛋白丝(F-actin)刚性结合的GFP荧光探针——POLArISact,并以海星卵母细胞和早期胚胎为生物模型,通过荧光偏振成像,揭示了肌动蛋白丝从中心体形成放射状延伸结构(FLARE)在海星的早期胚胎发育过程的功能。

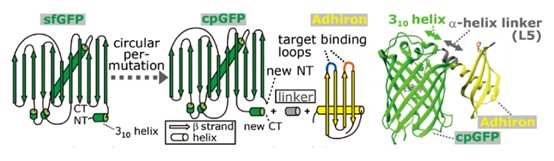
为了构建POLArISact,本工作利用了一种小型亲和性蛋白Adhiron(后命名为affimer,约12 kDa),通过刚性肽段将其N端的α螺旋与GFP的环状突变体cpGFP的C端α螺旋相连。Adhiron中含有两段可变肽段,位于其4个反向平行β片结构中间,能够特异性识别目标分子。通过筛选10种不同的连接肽段序列,研究发现序列为EAAAK的肽段在最大程度上实现了cpGFP与Adhiron的刚性连接。免疫共沉淀和荧光共定位等实验的结果证明,POLArISact在活细胞中可以特异地识别和结合F-actin,与鬼笔环肽标记的F-actin具有良好的共定位特征。冷冻电镜和荧光偏振成像结果进一步证实,cpGFP的荧光偶极子具有与肌动蛋白丝平行的取向特征。
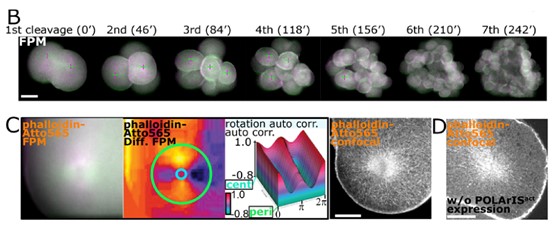
基于POLArISact的优异性能,研究人员以海星为生物模型,探究了在海星卵母细胞成熟和早期胚胎发育过程中,肌动蛋白的组织重塑过程。研究结果表明,从卵母细胞的细胞核崩解(germinal vesicle breakdown, GVBD)到受精及卵裂过程,肌动蛋白丝均表现出显著的方向性组织与重塑特征。
值得一提的是,研究团队通过荧光偏振成像首次发现,在早期胚胎发育过程中,肌动蛋白丝自中心体呈放射状延伸,形成与细胞分裂相关的特殊结构FLARE(FLuffy And Radial actin-aster associated with mitosis in Embryo)。进一步研究表明,FLARE的形成与微丝星状体的组织密切相关。通过使用Nocodazole抑制微丝聚集,可显著阻碍FLARE的形成及细胞分裂,揭示了该结构在细胞分裂中的重要作用。
综上,该研究提出了一种普适性方案,用于设计适配荧光偏振成像的刚性荧光分子探针。借助探针的基因编码特性,POLArIS能够应用于多种活体生物样本的成像,并在启动子操控下,实现不同细胞或组织的特异性时空标记。这为研究生物大分子的结构和功能提供了崭新的技术手段。此外,该研究以海星胚胎为模型,验证了荧光偏振成像在揭示分子动态过程中的独特优势,也展现了这一技术在生命科学研究中的广阔应用前景。
参考文献:
1. M. Ohmachi et al., Fluorescence microscopy for simultaneous observation of 3D orientation and movement and its application to quantum rod-tagged myosin V. Proc Natl Acad Sci U S A 109, 5294-5298 (2012).
2. J. N. Forkey, M. E. Quinlan, M. A. Shaw, J. E. Corrie, Y. E. Goldman, Three-dimensional structural dynamics of myosin V by single-molecule fluorescence polarization. Nature 422, 399-404 (2003).
3. H. Sosa, E. J. Peterman, W. E. Moerner, L. S. Goldstein, ADP-induced rocking of the kinesin motor domain revealed by single-molecule fluorescence polarization microscopy. Nat Struct Biol 8, 540-544 (2001).
4. T. Nishizaka et al., Chemomechanical coupling in F1-ATPase revealed by simultaneous observation of nucleotide kinetics and rotation. Nat Struct Mol Biol 11, 142-148 (2004).
5. V. Swaminathan et al., Actin retrograde flow actively aligns and orients ligand-engaged integrins in focal adhesions. Proc Natl Acad Sci U S A 114, 10648-10653 (2017).
6. P. Nordenfelt et al., Direction of actin flow dictates integrin LFA-1 orientation during leukocyte migration. Nat Commun 8, 2047 (2017).
7. K. Zhanghao et al., Super-resolution imaging of fluorescent dipoles via polarized structured illumination microscopy. Nat Commun 10, 4694 (2019).
8. S. B. Mehta et al., Dissection of molecular assembly dynamics by tracking orientation and position of single molecules in live cells. Proc Natl Acad Sci U S A 113, E6352-E6361 (2016).
9. A. Sugizaki et al., POLArIS, a versatile probe for molecular orientation, revealed actin filaments associated with microtubule asters in early embryos. Proc Natl Acad Sci U S A 118, (2021).
原文链接:
https://doi.org/10.1073/pnas.2019071118

