撰文 | 曹睿杰 席鹏
审阅 | 曹睿杰 席鹏
1 研究背景介绍
由于快速、低光毒性、高染料兼容性的优势,结构光照明显微成像(SIM)成为细胞器动态观测最有力的超分辨显微技术。随着SIM的发展,国内外专家学者们一系列关于SIM的算法工作,如Open-SIM1,fairSIM2,Hessian-SIM3,HiFi-SIM4等等,这些开源软件也促进了一系列的硬件进展,如SLM-SIM5,DMD-SIM6,以及商业化的系统如Airy-SIM7等,算法与硬件的结合使得SIM领域变得开放而充满活力。
2008年,Gustafsson课题组首次提出了3DSIM8的概念,3DSIM相对于2DSIM有着纵向平面分辨率的两倍提升,极大地消除了2DSIM中常见的离焦背景并获得了全细胞成像的能力。但由于3DSIM的复杂性,3DSIM的发展总体而言落后于2DSIM,其算法要么存在于闭源的商用系统中,要么基于传统的Weiner-3DSIM,用户友好度较低且伪影较为严重。特别是,随着中国SIM技术的不断崛起,国际两大巨头GE和Nikon基于商业原因退出SIM领域,这对3DSIM的维护与发展非常不利。因此,一个开源且强大的3DSIM软件急需被开发,以适应3DSIM日益增长的发展需求。
2. 摘要
2023年7月20日,北京大学席鹏教授课题组在Nature Methods上发表了题为“Open-3DSIM: an open-source three-dimensional structured illumination microscopy reconstruction platform”的研究。该研究继席鹏教授课题组提出的2DSIM重建平台Open-SIM1后(IEEE JSTQE2018),开发了全新的开源3DSIM重建平台——Open-3DSIM, Open-3DSIM建立在MATLAB,Fiji以及Exe软件平台上,以供不同需求的用户使用。它具有高保真、低伪影的优势,在低信噪比条件下也有着很好的重建效果。此外,偏振偶极子成像的引入使得Open-3DSIM具有偏振成像的能力,从而构建了横向/纵向超分辨,多色,长时程,及偶极子取向的六维重建模态。
3. 结果分析与阐述
为了解决目前3DSIM软件用户友好度低的不足,席鹏教授课题组将Open-3DSIM平台建立在MATLAB,Fiji以及Exe软件平台上,以供不同需求的用户使用:
ImageJ版本:适合于熟悉ImageJ的用户,可以利用ImageJ的强大功能;
Exe版本:适合于基础用户,可以导入数据直接生成超分辨结果;
Matlab版本:适合于开发者使用,可以进一步发展后续的图像优化算法。
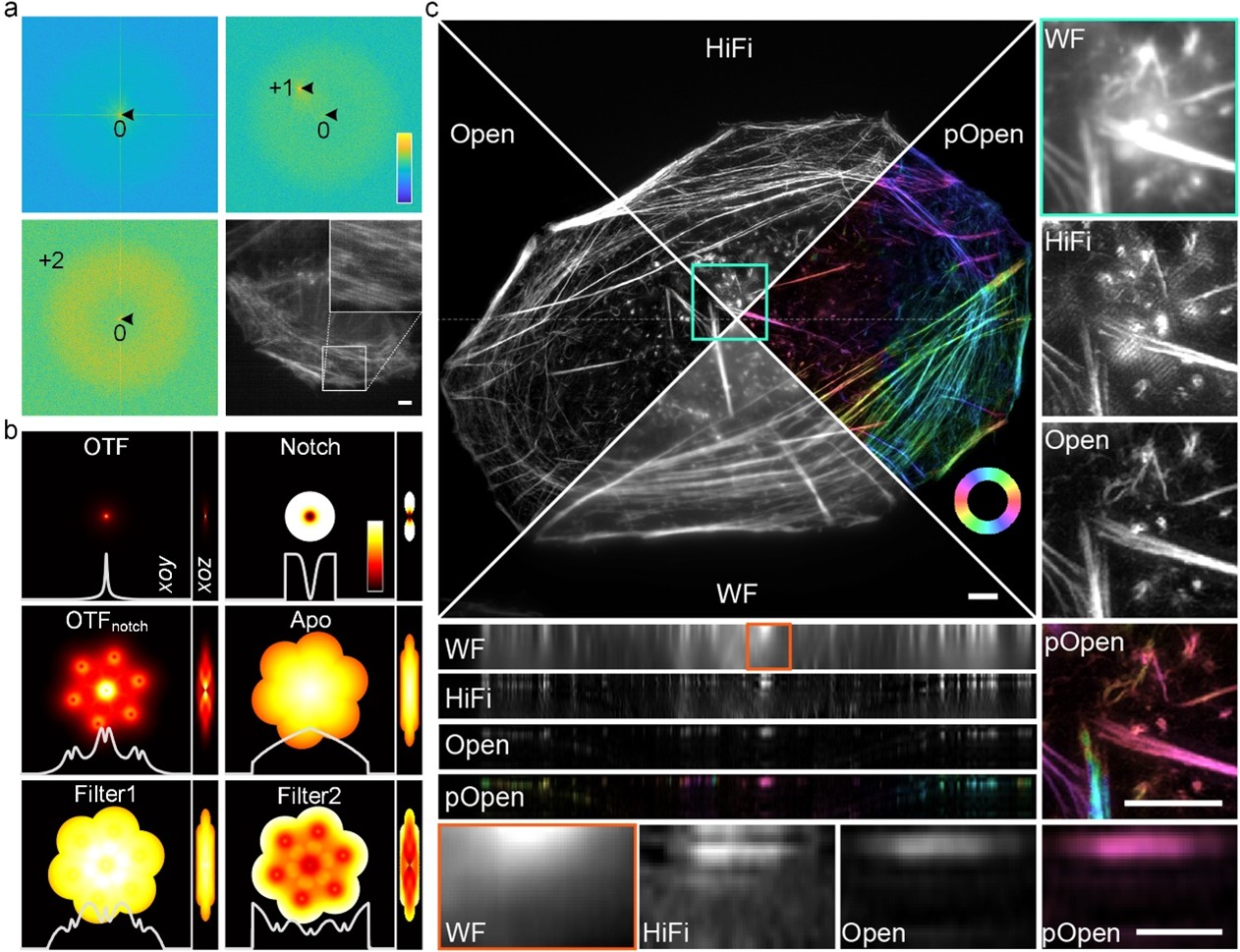
图1. a,低信噪比、低调制度条件下通过±1级与±2级频谱尖峰点进行协同参数估计。b,根据系统光学转换函数与估计的参数设计的各类频谱优化滤波器。c,Open-3DSIM与宽场图像(WF),单层3DSIM算法(HiFi-SIM)的对比以及基于Open-3DSIM的偶极子取向解析(pOpen)。
为了提高3DSIM的重建效果,席鹏教授课题组首次提出了自适应参数估计方法,通过正负一级与正负二级频率尖峰点进行协同参数估计,极大地提高了低信噪比、低调制度条件下3DSIM参数估计的准确性。同时设计了一系列频域滤波操作进行伪影的抑制与弱细节的保留,包括设计陷波函数抑制六角伪影,设计一级滤波函数抑制旁瓣与振铃伪影,设计二级滤波函数保留细节信息并提高重建分辨率等。这些优化在确保重建保真性的同时,极大的抑制了3DSIM重建的离焦背景与各类伪影,使得Open-3DSIM的重建效果全面优于现有的各类重建算法(AO-3DSIM9,4BSIM10,SIMnoise11等)与商用重建软件(GE | OMX等)。尤其在极低信噪比条件下,Open-3DSIM和其他算法在低信噪比条件下的均方误差(MAE)和信噪比(SNR)相近,这展示了Open-3DSIM在低信噪比情况下优越的重建性能。
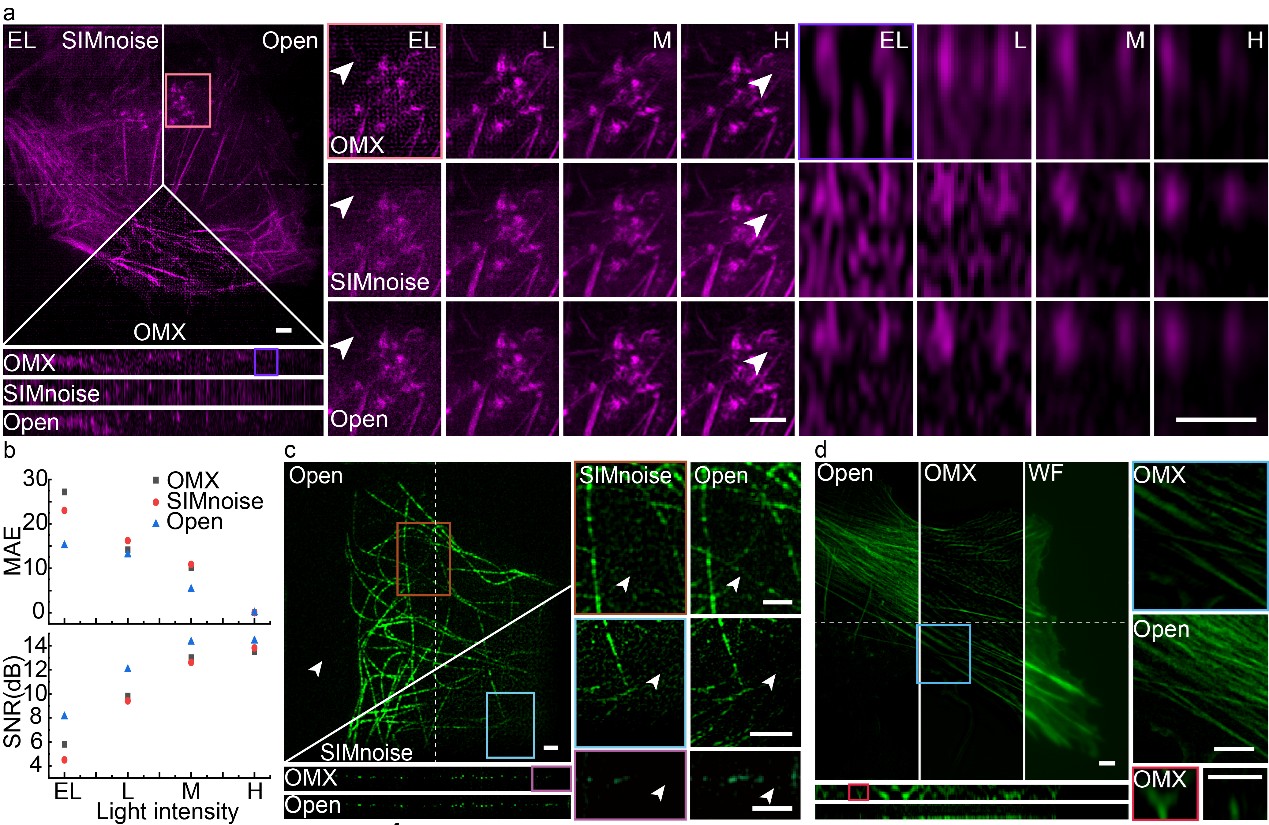
图2. Open-3DSIM优于现有的商业(GE | OMX)与开源(SIMnoise,Nature Methods)算法。a, 梯度光强激发下(EL, 极低光强,L,低光强,M,中等光强,H,高光强),三种算法对微丝样本重建结果的分析以及b,均方误差(MAE)和信噪比(SNR)对比。c, 极低信噪比条件下SIMnoise和Open-3DSIM对微管样本的重建对比。d, 极低信噪比条件下OMX与Open-3DSIM对微丝样本的重建对比。
此外,席鹏教授课题组根据荧光对不同角度偏振光发射强度不同的原理,将荧光偏振取向信息引入3DSIM重建的后处理当中,使得在无需任何硬件改动的前提下即可获取各类生物样本的偶极子取向信息。如图 3所示,由于Open-3DSIM低伪影、高分辨率的优势,他们成功对Cos-7细胞进行了三色成像,并解析了线粒体嵴的三维结构与其动态分离融合过程,获得了5um小鼠肾切片微丝细胞器的三维偶极子取向信息。Open-3DSIM提供了横向/纵向超分辨,多色,长时程以及偶极子取向的六维(XYZlθT)重建技术,为亚细胞器的多维动态成像提供了有利工具。
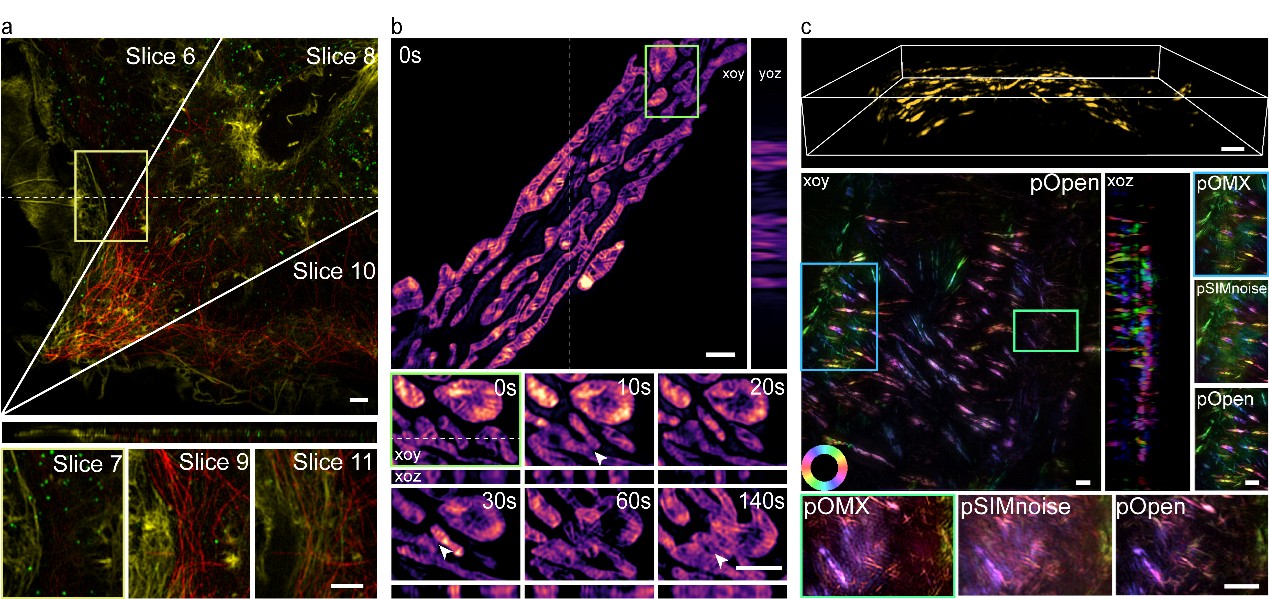
图3 Open-3DSIM建立横向/纵向超分辨、多色、动态、偏振的六维成像模态。a,重建多色Cos-7细胞样本,b,解析Cos-7细胞三维线粒体的分裂、融合、凋亡,以及c, 获得小鼠肾切片微丝结构的荧光偶极子信息。
4. 文章结论与讨论
Open-3DSIM并不局限于单一显微镜平台,它广泛适用于GE | OMX,Nikon | N-SIM等商用或各类自制的3DSIM系统。它与各种现有的基于正则/反卷积/机器学习的图像优化方法完全兼容,其优越的性能、模块化的设计、极高的用户友好性为下一代3DSIM技术提供了坚实的软件基础。尽管Open-3DSIM极大地提高了低光强激发下3DSIM的重建效果,但由于3DSIM较强的光毒性,其在活细胞成像中任然面临着种种困难,更为先进的硬件、后续的图像优化算法、以及新型染料的出现有望解决这一问题。席鹏希望Open-3DSIM能够成为国际3DSIM重建的标准,以促进3DSIM在多维活细胞超分辨成像领域的进一步发展。
5. 原文链接
论文链接为:https://doi.org/10.1038/s41592-023-01958-0,文中的相关代码与重建平台公布于Github:https://github.com/Cao-ruijie/Open3DSIM,作者们还开源了3DSIM的示例数据与重建参数于Figshare:https://figshare.com/articles/dataset/Open_3DSIM_DATA/21731315,供用户测试使用。
6. 作者简介
这一工作中,北京大学未来技术学院博士生曹睿杰为第一作者,北京大学未来技术学院席鹏教授为通讯作者,北京大学未来技术学院为第一单位。作者感谢北京大学生命仪器平台为论文提供的硬件平台,及艾克斯马赛大学(Aix Marseille University)的Christophe Leterrier 博士提供N-SIM数据。作者感谢李辉教授(中国科学院苏州医工所,Hifi-SIM发明者)、Marcel Mueller教授(鲁汶大学,fairSIM发明者)、邵林教授(耶鲁大学,3D-SIM发明者)对本文的细致审稿与建设性的宝贵意见。本工作受到国家自然科学基金、科技部重点研发计划等项目的资助。
7. 参考文献
1. Lal, A., Shan, C. & Xi, P. Structured illumination microscopy image reconstruction algorithm. IEEE J. Quantum Electron. 22, 50–63 (2016). https://ieeexplore.ieee.org/document/7400963
2. Müller, M. et al. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nat. Commun. 7, 19080 (2016). https://doi.org/10.1038/ncomms10980
3. Huang, X. et al. Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy. Nat. Biotechnol. 36, 451–459 (2018). https://doi.org/10.1038/nbt.4115
4. Wen, G. et al. High-fidelity structured illumination microscopy by point-spread-function engineering. Light.: Sci. Appl. 10, 70 (2021). https://doi.org/10.1038/s41377-021-00513-w
5. Xu, L. et al. Structured illumination microscopy based on asymmetric three-beam interference. J. Innov. Opt. Health Sci. 14, 2050027 (2021). https://doi.org/10.1142/S1793545820500273
6. Li, M. et al. Structured illumination microscopy using digital micro-mirror device and coherent light source. Appl. Phys. Lett. 116, 233702 (2020). https://doi.org/10.1063/5.0008264
7. Airy Polar-SIM. https://www.airy-tech.cn (2022).
8. Gustafsson, M. et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94, 4957–4970 (2008). https://doi.org/10.1529/biophysj.107.120345
9. Lin, R. et al. Subcellular three-dimensional imaging deep through multicellular thick samples by structured illumination microscopy and adaptive optics. Nat. Commun. 12, 3148 (2021). https://doi.org/10.1038/s41467-021-23449-6
10. Li, X. et al. Three-dimensional structured illumination microscopy with enhanced axial resolution. Nat. Biotechnol. https://doi.org/ 10.1038/s41587-022-01651-1 (2023). https://doi.org/10.1038/s41587-022-01651-1
11. Smith, C. et al. Structured illumination microscopy with noise-controlled image reconstructions. Nat. Methods 18, 821–828 (2021). https://doi.org/10.1038/s41592-021-01167-7




 公安备案号:京公网安备11010802046288号
公安备案号:京公网安备11010802046288号